天津专升本:2022年天津仁爱学院高职升本化学工程工艺专业《无机化学》考试大纲
天津仁爱学院2022年高职升本化学工程与工艺专业无机化学考试大纲
一、考试性质
天津市普通高校“高职升本科”招生考试是由合格的高职高专毕业生参加的选拔性考试。无机化学是一门培养学生具有化学基本知识和能力的必修课。主要研究无机化学常见元素单质、化合物的性质,化学平衡原理及其平衡移动的一般规律和有关理论。通过学习,使学生了解和掌握有关的化学基本知识、基本原理及基本实验技能,了解这些知识、理论和技能的应用,培养分析和解决涉及化学实际问题的能力,为今后的学习和工作打下一定的基础。
二、考试能力要求
本考试要求将《无机化学》等基本知识、基本理论、化学计算等知识分为识记、理解、分析计算、综合应用四个层次。识记:指对相关课程中的有关术语、基本概念、基本知识、基本技能和基本方法能直接应用。理解:指对相关课程中的概念、公式、方法、基本定律和元素的基本性质有一定的理性认识,在理解的基础上能运用所学知识与简单的实际问题相联系。分析计算:指在理解元素的化学性质及相关基本定律和计算公式的基础上进行有关化学计算。综合应用:指能综合运用化学知识解决简单的实际问题。
三、考试内容与要求
无机化学课程体系包括四部分内容:
化学反应原理及规律——物质结构理论及知识——元素化学知识——化学实践,归纳为“理论---知识---实践”“理论”应侧重于理解及其应用;“知识”在理解的基础上侧重记忆;“实践活动”侧重于实验。
了解(A):对所列知识内容有初步的认识,会在有关问题中进行识别和直接应用.
理解(B):对所列知识内容有理性的认识,能够解释、举例或变形、推断,并利用所列知识解决简单问题。
掌握(C):对所列知识内容有较深刻的理性认识,形成技能,并能利用所列知识解决有关问题。
第1章 化学反应中的质量关系和能量关系
[要求]
1. 了解物质聚集状态的基本概念
2. 理解体系与环境、状态函数、热、功、热力学能(内能)的概念和标准摩尔生成焓的含义
3. 掌握热化学方程式的书写和Hess定律的应用
4. 掌握热化学相关计算
[重难点]
1.焓变、熵变、自由能变的计算
2.Hess定律的应用
第2章 化学反应的方向、速率和限度
[要求]
1. 了解化学反应速率的概念、表示方法和反应速率方程
2. 掌握浓度(或分压)、温度、催化剂对化学反应速率的影响
3. 掌握化学平衡的特征、标准平衡常数的含义及平衡移动的原理
4. 掌握化学平衡的有关计算
[重难点]
1. 判断化学反应速率的影响因素
2. 进行有关化学平衡的计算并说明浓度、压力、温度对化学平衡移动的影响
3.化学平衡的有关计算
第3章 酸碱反应和沉淀反应
[要求]
1. 理解溶液的酸碱性与pH,弱电解质的解离平衡与解离度、稀释定律。盐类水解,同离子效应、缓冲溶液、沉淀溶解平衡、溶度积规则
2. 掌握一元弱酸、弱碱的解离平衡组成,盐类水解(含同离子效应的pH值计算)
3. 掌握沉淀-溶解平衡的特点,会用溶度积规则判断沉淀生成、分步沉淀有关计算
[重难点]
1. 计算一元弱酸、一元弱碱、缓冲溶液及某些盐类的pH
2. 进行溶度积和溶解度之间的换算并运用溶度积规则判断沉淀的生成或溶解
第4章 氧化和还原反应与应用电化学
[要求]
1. 掌握氧化还原反应的基本概念并配平反应方程式
2. 理解标准电极电势、电极电势及原电池电动势的概念
3. 掌握电极反应、电池符号的表示方法
4. 理解能斯特方程并掌握影响电极电势的因素和应用
5. 理解元素电势图的应用,会判断是否发生歧化,物质是否稳定
[重难点]
1. 配平氧化还原反应方程式并根据能斯特方程进行有关电极电势的计算
2. 根据电极电势判断反应的方向,比较氧化剂、还原剂的相对强弱,利用元素标准电势图判断歧化反应进行的方向
第5章 原子结构与元素周期性
[要求]
1. 了解原子核外电子运动状态的基本特点,原子轨道和波函数,电子云和概率密度的概念和关系
2. 掌握四个量子数的意义及取值规律
3. 掌握原子核外电子排布原理(两个原理一个规则)
4. 掌握元素的原子半径等元素基本性质的周期性变化
[重难点]
1. 用四个量子数描述原子中电子的运动状态
2. 分析原子的电子层结构与元素周期表、元素性质之间的关系
第6章 分子结构与性质
[要求]
1.了解化学键的含义共价键的形成条件、特征(方向性,饱和性)和共价键类型 (σ键π键 )
2. 理解杂化轨道理论的要点,掌握以sp,sp2和sp3杂化轨道成键分子的空间构型
3. 理解分子轨道理论及应用
4. 掌握范德华力和氢键的概念
[重难点]
1.会用sp,sp2和sp3杂化轨道成键情况判断分子的空间构型
2.会根据范德华力和氢键说明其对物质性质的影响
第7章 固体结构和性质
[要求]
1.了解晶体和非晶体概念
2. 掌握不同类型晶体(离子晶体、原子晶体、分子晶体、金属晶体)的结构特征 及其与物质性质关系。
[重难点]
1. 离子晶体的熔点,硬度比较
第8章 配位化合物
[要求]
1. 了解配合物基本概念。掌握配合物的组成命名
2. 理解价键理论,能用来说明配合物的空间构型、稳定性和磁性
3. 掌握配位平衡、稳定常数及其计算
[重难点]
1. 价键理论
2. 配位平衡、稳定常数及其计算
第9章 氢、稀有气体
[要求]
1. 掌握氢的制备、性质和用途
第10章 碱金属和碱土金属
[要求]
1. 理解碱金属和碱土金属的重要反应,氧化物和氢化物的类型与性质
2. 掌握 碱金属和碱土金属氢氧化物的性质及其递变规律
[重难点]
1. 碱金属和碱土金属的氧化物和氢化物的类型与性质
2. 碱金属和碱土金属氢氧化物的性质及其递变规律
第11章 卤素和氧族元素
[要求]
1. 了解卤素的通性和氟的特殊性
2. 掌握 卤化氢的制备和性质(还原性、热稳定性,卤氢酸的酸性)
3. 掌握 氯的含氧酸(次氯酸、氯酸、高氯酸)及其盐的性质递变规律
4. 掌握过氧化氢的性质、制备和用途
5. 掌握硫的含氧酸(亚硫酸、硫酸、焦硫酸、硫代硫酸)及其盐的性质、用途
[重难点]
1. 卤化氢的制备和性质(还原性、热稳定性,卤氢酸的酸性)
2. 氯的含氧酸(次氯酸、氯酸、高氯酸)及其盐的性质递变规律
3. 过氧化氢的性质、制备和用途
第12章 氮族、碳族和硼族元素
[要求]
1. 理解 氨和铵盐的性质
2. 掌握硝酸、亚硝酸及其盐的性质
3. 掌握 碳、硅的氧化物、含氧酸及其盐的性质
4. 理解三氯化铝的结构和性质。矾的概念
5. 掌握惰性电子对效应
6. 了解对角线规则
[重难点]
1. 氨和铵盐的性质
2. 硝酸、亚硝酸及其盐的性质
3. 对角线规则
第13章 过渡元素(一)
1. 掌握 Cr(Ⅲ)和Cr(Ⅵ)重要化合物的性质,其中Cr(Ⅲ)化合物的还原性,Cr(Ⅵ)化合物的氧化性,重铬酸盐的难溶性,CrO42-和Cr2O72-的相互转变
2. 掌握 锰的重要化合物的性质,重点Mn2+,MnO4- 重要反应
3. 掌握铁、钴、镍的M(Ⅱ)氧化态稳定性,M(Ⅱ)化合物还原性,M(Ⅲ)化合物氧化性变化规律
4. 理解CrO42-,Cr3+,Mn2+的鉴定
第14章 过渡元素(二)
1. 掌握卤化银的难溶性,硝酸银的不稳定性,银镜反应,
2. 掌握Cu(Ⅰ)和Cu(Ⅱ)的相互转化
四、考试方式与试卷结构
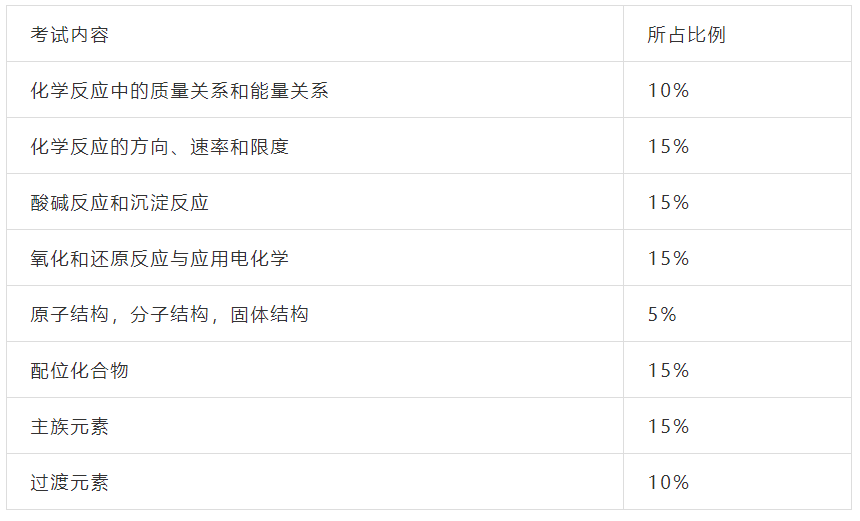
五、典型题示例
为了便于理解考试内容和要求,特编制下列题型示例,以供参考. 所列样题力求体现试题的各种题型及其难度,它与考试时试题的数目、题序安排、考查内容、难度没有对应关系.
判断题(容易题)
( × ) 由于CH4为非极性分子,所以CH4分子中无极性键。
( √ ) 温度一定,对某一可逆反应达平衡后,其不随浓度、分压而改变。
3. ( × ) 弱电解质HOAc溶液越稀,解离度越大,溶液中H+离子浓度越大。
4. ( √ ) 在周期表中的Be-Al,处于对角线位置,性质相似。
5. ( × ) 加热CuCl2·2H2O时可得到无水的CuCl2。
选择题
1. ( A )欲使Mg(OH)2溶解,可加入______。(容易题)
A. NH4Cl B. NaCl C. NaOH D. NH3•H2O
2. ( B ) 在缓冲溶液中加入少量强酸、强碱,溶液pH值__________。(容易题)
A. 变大 B. 基本不变 C. 变化很大 D. 变小
3. ( A )有关分步沉淀下列叙述正确的是_________。(中等题)
A. 所需沉淀剂浓度小者首先沉淀 B. 溶解度小的先沉淀出来
C. 溶度积小的先沉淀出来 D. 被沉淀离子浓度大者先沉淀出来4. ( B )下列物质 属于矾类的是________。(容易题)
A. Fe(SO4)2•7H2O B. KCr(SO4)2•12H2O
C. CuSO4•5H2O D. Al2 (SO4)3 •16H2O
5. ( C )用于说明Pb(IV) 具有强氧化性的是________。(中等题)
A.屏蔽效应 B.钻穿效应
C.惰性电子对效应 D.螯合效应
6. ( C )下列浓酸中,可以用来和KBr(s)反应制取较纯HBr的是_____。(中等题)
A.浓H2SO4 B.浓HNO3 C.浓H3PO4 D.浓HCl
填空题
1. 在NH3·H2O溶液中加入NH4OAc会使NH3·H2O的解离度__降低__,在有CaCO3(s)存在的饱和溶液中,加入CaCl2, 会使CaCO3的溶解度_降低__。(容易题)
2. 根据( Cr2O7 2- / Cr3+) >(Fe3+/Fe2+) > (Sn4+/Sn2+),可以判断在组成电对的各种物质中, Cr2O7 2- 的氧化能力最强, Sn2+ 的还原能力最强。(中等题)
3. KMnO4 是常用的氧化剂,在酸性、中性和强碱性介质中被还原的产物分别是 _ Mn2+ 、_ MnO42- __、_ MnO2 _。
完成并配平反应
2MnO4- + 5SO32- + 6H+ → 2Mn2+ + 5SO42- + 3 H2O
(中等题)
MnO 与硼砂Na2B4O7 共融
MnO + Na2B4O7 → Mn(BO2)2• 2NaBO2
(中等题)
2[Cr(OH)4]- + 3H2O2 + 2 OH- → 2 Cr2O4 2- + 8H2O
(中等题)
计算题
已知:(NO) = 90 kJ·mol-1,(NOF) = -66.5 kJ·mol-1,(NO)= 211 J·mol-1· K-1, (NOF) = 248 J·mol-1· K-1,(F2) = 203 J·mol-1· K-1。试求: (1)反应2 NO(g)+F2(g) 2NOF(g) 在298K 时的平衡常数;
(2)以上反应在500K 时的和。(中等题)
答案(略)
已知Eθ(MnO4-/Mn2+)=1.5V,Eθ (Fe3+/Fe2+)=0.77V,
将这两个半电池组成原电池,并计算其标准电动势Eθ,并判断反应:
MnO4-+ 5Fe2++8H+ Mn2++ 5Fe3++4H2O 进行的方向
(2)当c(H+)=10.0mol·L-1,其他各离子浓度均为1.0mol·L-1时,计算该电池的电动势E。(难题)
答案(略)
3. 将 5.0×10-3L 0.20 mol·L-3 的 MgCl2 溶液与 5.0×10-3 L 0.10 mol·L-3 的氨水混合时 ,通过计算说明有无 Mg (OH)2 沉淀生成 ?为了使溶液中不析出Mg (OH)2 沉淀 ,在溶液中至少要加入多少克固体 NH4Cl 。
(忽略加入固体NH4Cl时的体积变化,KbΘNH3=1.81×10-5 ,KspΘMg (OH)2=1.8×10-11 ,NH4Cl 式量 53.5 )(难题)
答案(略)













